Лимфоциты кишечника регулируют интенсивность метаболизма, действуя на кишечные клетки и кишечные гормоны.
В кишечнике очень много иммунных клеток, и неудивительно: во-первых, инфекции зачастую проникают в тело именно через кишечник, во-вторых, здесь же обитает масса симбиотических бактерий, без которых нам бы жилось намного труднее. Кишечный департамент иммунной системы должен постоянно уничтожать патогенных нарушителей и одновременно не трогать дружественную микрофлору.
Наши «домашние» кишечные бактерии влияют на множество физиологических процессов, и в первую очередь на обмен веществ. Можно предположить, что иммунитет, который постоянно общается с микрофлорой, косвенно действует и на метаболизм тоже – мы уже как-то писали, что иммунная система влияет на сахарный обмен через кишечных бактерий.
Но иммунные клетки, которые сидят в кишечнике, могут и сами регулировать обмен веществ. Известно, что Т-лимфоциты, которые сидят в кишечном эпителии, часто скапливаются там, где особенно активно всасываются питательные вещества; кроме того, у них активно работают гены, управляющие метаболизмом, и сами клетки путешествуют по эпителию не только когда организму угрожает какая-то инфекция, но и по каким-то другим причинам.
Исследователи из Гарварда и Йеля с помощью генетических модификаций создали мышей, у которых лимфоциты лишены интегрина β7. Это мембранный белок, который помогает лимфоцитам взаимодействовать с эпителиальными клетками. В результате количество лимфоцитов в кишечном эпителии у таких мышей сильно падало.
Одновременно у животных разгонялся обмен веществ: бурый жир, задача которого – сжигать жировые запасы, вдруг начинал заниматься этим чрезвычайно активно, а поджелудочная железа начинала выбрасывать в кровь очень много инсулина, сильно снижая уровень сахара. Таких мышей пробовали держать на вредной диете с большим количеством жира и сахара, но, несмотря на вредную диету, у животных не появлялось признаков метаболического синдрома, который обычно сопутствует ожирению, диабету второго типа, проблем с сосудами и т. д.
Похожие вещи происходят при повышении уровня глюкагоноподобного пептида-1, который синтезируют так называемые L-клетки кишечного эпителия. Синтезируют они его либо под действием нервного сигнала, либо в ответ на появление сахара или желчных кислот (которые, в свою очередь, появляются в кишечнике в ответ на жиры). Глюкагоноподобный пептид-1 заставляет поджелудочную железу вырабатывать больше инсулина, и заодно стимулирует прирост инсулинсинтезирующих клеток. Кроме того, этот пептид замедляет перистальтику желудочно-кишечного тракта и заставляет нейроны отправлять в мозг сигналы насыщения. То есть в целом глюкагоноподобный пептид-1 помогает меньше есть и одновременно помогает избавляться от лишних калорий.
Поэтому возникла гипотеза, что иммунитет регулирует обмен веществ, действуя на этот пептид. Всё так и оказалось: в статье в Nature говорится, что у мышей, у которых в кишечнике было мало Т-лимфоцитов, было больше как пептида, так и синтезирующих его L-клеток. Иммунные клетки управляют обменом веществ напрямую, влияя на появление новых L-клеток и поглощая пептид, который они выделяют. Как пишет портал Nature, можно предположить, что иммунитет работает добавочным регулятором обмена веществ, настраивая его на разные условия среды. Ведь когда еды мало, то желательно, чтобы L-клетки и их пептид особо не активничали; и наоборот, когда еды много и организму, чего доброго, грозит ожирение, то L-клетки и их пептид должны работать, так сказать, не покладая рук.
Разумеется, тут сразу возникает вопрос, как сами Т-лимфоциты чувствуют, как нужно отрегулировать метаболизм. Очевидно, в иммунной системе для этого должен стоять некий «датчик снабжения», который определял бы, сколько в теле хранится запасов, как индивидуум питается и т. д.
С другой стороны, интересно, как Т-лимфоциты сочетают такую работу со своей прямой функцией – защитой организма от бактерий, вирусов и пр. Кишечные Т-лимфоциты работают в особых условиях, но ведь генетически они не отличаются от тех, которые находятся в других местах – значит, есть какие-то молекулярные механизмы, которые делают из кишечных Т-лимфоцитов тех, кто они есть.
Ответив на эти и другие вопросы, мы не только больше узнаем об иммунитете, но и, возможно, найдём новый способ бороться с избыточным весом, диабетом и прочими расстройствами, связанными с обменом веществ.
Как микрофлора кишечника связана с иммунитетом
 Малейший сквозняк и вы опять простыли? Ну не расстраивайтесь, сегодня мы с вами, дорогие друзья, попытаемся обнаружить причины нашего ослабленного иммунитета в самых неожиданных местах. А также узнаем о том, как природными способами восстановить микрофлору кишечника, а значит, укрепить иммунитет и все наше здоровье в целом.
Малейший сквозняк и вы опять простыли? Ну не расстраивайтесь, сегодня мы с вами, дорогие друзья, попытаемся обнаружить причины нашего ослабленного иммунитета в самых неожиданных местах. А также узнаем о том, как природными способами восстановить микрофлору кишечника, а значит, укрепить иммунитет и все наше здоровье в целом.
Как-то непривычно связывать бесконечные сопли и кашель с запором, поносом или бурчанием в животе. Но медики категоричны: подверженность простудным заболеваниям часто реакция организма на состояние кишечника.
Дело в том, что микрофлора ЖКТ (желудочно кишечного тракта) – очень важная часть иммунной системы человека. Чем хуже себя чувствуют жизненноважные бактерии и микроорганизмы, обитающие в кишечнике, и чем их меньше, тем больше проблем в туалете и ниже иммунитет.
Около 70% иммуномодулирующих клеток человека находится в желудочно кишечном тракте. Это значит, что наше здоровье в сезон простуд во многом зависит от благополучия ЖКТ.
Факторы, подавляющие иммунитет и уничтожающие микрофлору
Краткая медзаметка:
При урогенитальной или ректальной форме заболеваний герпесом весьма эффективно использовать специальные, мягко растворимые под действием тепла человеческого тела, свечи против герпеса. Противовирусные и иммуностимулирующие действия этого лекарства ущемляют активность размножающихся клеток вируса и активизируют иммунные силы организма, запуская эффект самолечения. Кроме того, данный медицинский препарат назначают даже детям, у которых, к примеру, присутствуют противопоказания к инъекционным препаратам.
Природное восстановление микрофлоры кишечника
Самый простой способ поддержать ослабленную микрофлору кишечника подселить к ней новых "жильцов" – полезные бактерии пробиотики. Больше всего их содержится в кисломолочных продуктах (кефир, питьевой йогурт, простокваша, сыр мацони) и квашеной капусте. В отличие от квашеной капусты, которую желательно квасить самостоятельно и употреблять в любых количествах, кисломолочные продукты следует тщательно выбирать и обращать пристальное внимание на состав. Кроме того, употребление их два-четыре раза в неделю будет вполне достаточно, как бы не очень-то желательно чересчур уж сильно на них подсаживаться.
Кроме того, богат пробиотиками хлеб на закваске (лучше всего приготовить самостоятельно на ржаной муке, рисе, изюме, хмелевых шишках и других природных ингредиентах – Интернет вам в помощь), а также такие растения как артишоки, репчатый лук и лук-порей. Немного наших драгоценных бактерий содержится и в свежих бананах.
Также пробиотики часто выпускаются в виде пищевых добавок, перед употреблением которых следует обязательно посоветоваться с терапевтом.
Многие общие закономерности иммунитета слизистых оболочек были выявлены и детально изучены на примере кишечного иммунитета. По массе иммунокомпетентных клеток кишечнику принадлежит ведущее место в иммунной системе слизистых покровов, и в этом отношении он значительно превосходит иммунную систему респираторного тракта.
Кишечник — важный иммунологический орган, в собственной пластике (lamina propria) которого содержится столько же лимфоидных клеток, сколько в селезенке. Среди этих клеток идентифицированы Т-, В-клетки, малые лимфоциты и плазматические клетки. Последние синтезируют иммуноглобулины преимущественно класса А и являются источником антител, секретируемых слизистой оболочкой кишечника. Многочисленные малые лимфоциты контролируют выработку антител и, кроме того, осуществляют реакции клеточного иммунитета. Иммунологическая функция кишечника опосредована действием, прежде всего, лимфоцитов, расположенных в пейеровых бляшках и в слизистой оболочке. Популяция лимфоцитов пейеровых бляшек состоит из предшественников В-(80%) и Т-(20%) клеток.
Лимфоциты эпителиального слоя кишечной стенки представлены исключительно Т-клетками, тогда как в подслизистом слое преобладают В-клетки, большинство из которых синтезируют IgA. Исключение составляют жвачные животные, у которых в подслизистом слое преобладают IgG, продуцирующие клетки.
Иммунитет против энтеропатогенных агентов в основном осуществляется посредством антител, секретируемых в просвет кишечника. Антитела, защищающие слизистую оболочку кишечника, могут поступать из двух источников: из сыворотки крови и плазматических клеток, расположенных в lamina propria. Сывороточные антитела, очевидно, менее эффективны, поскольку достаточное для местной защиты количество их накапливается в кишечнике только при наличии высоких уровней в сыворотке крови. Сывороточные антитела, участвующие в создании местного иммунитета, проникают в просвет кишечника в результате экссудации и относятся преимущественно к классу IgG.
Защитный эффект при гриппе обеспечивается главным образом продукцией циркулирующих антител и других факторов системного иммунитета, которые защищают от инфекции легкие, но слабо ограничивают размножение вируса в верхней части респираторного тракта. Подобным образом циркулирующие антитела (IgG) могут переноситься из крови в желудочно-кишечный тракт и защищать телят от ротавирусной инфекции.
Однако антитела, синтезируемые местно плазматическими клетками кишечника, обычно относятся к IgA и в силу устойчивости к протеолитическим ферментам в большей степени приспособлены к защите поверхности слизистой оболочки, чем IgG. Иммунная система кишечника во многом функционирует независимо от системных иммунных механизмов. Это прежде всего относится к иммунной системе кишечника свиней. Антигенная стимуляция В- и Т-клеток происходит в пейеровых бляшках, представленных отдельными скоплениями лимфоидных клеток, расположенных в подслизистом слое тонкого отдела кишечника.
Эпителий слизистой оболочки кишечника, покрывающий пейеровы бляшки, видоизменен: он образует лишь рудиментные ворсинки и обладает повышенной способностью к пиноцитозу Эти эпителиальные клетки обладают специализированной функцией «захвата» антигена из просвета кишечника и представляют его лимфоидным элементам бляшек. Они утратили характерную цилиндрическую форму, содержат много цитоплазматических вакуолей и называются мембранными или М-клетками, так как имеют микроскладки.
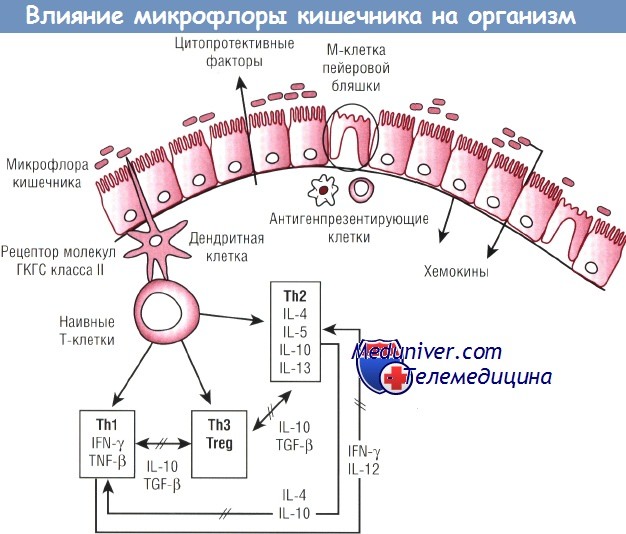 Эпителий кишечника способен распознавать микроорганизмы благодаря наличию трех типов клеток: дендритных клеток, М-клеток пейеровых бляшек и эпителиальных клеток кишечника. Взаимодействие с бактериями может обусловить возникновение иммунных Th1- и Th2-ответов, которые удерживаются в равновесии благодаря цитокинам и регуляторным Т-клеткам (Treg). Кроме того, воздействие бактерий может привести к продукции как хемокинов, так и цитопротективных факторов.
Эпителий кишечника способен распознавать микроорганизмы благодаря наличию трех типов клеток: дендритных клеток, М-клеток пейеровых бляшек и эпителиальных клеток кишечника. Взаимодействие с бактериями может обусловить возникновение иммунных Th1- и Th2-ответов, которые удерживаются в равновесии благодаря цитокинам и регуляторным Т-клеткам (Treg). Кроме того, воздействие бактерий может привести к продукции как хемокинов, так и цитопротективных факторов.
IFN — интерферон;
IL — интерлейкин;
TCF — трансформирующий фактор роста;
Th — Т-хелперы;
TNF — фактор некроза опухоли;
ГКГС — главный комплекс гистосовместимости
Частота формирования ротавирусспецифичных Тц-лимфоцитов в пейеровых бляшках после перорального инфицирования в 25—30 раз превышала частоту образования соответствующих клеток после инокуляции вируса в лапу мышей. Эффективность энтеральной иммунизации ротавирусом связывают со способностью его проникать в ткань пейеровых бляшек. Полагают, что реовирусы преодолевают кишечный эпителий благодаря М-клеткам, играющим ведущую роль в доставке чужеродных антигенов и, в том числе, вирусов во внутреннюю среду организма и к его иммунной системе. Эпителиальные клетки, подобные М-клеткам кишечника, обнаружены и среди клеток BALT, их рассматривают как респираторные эквиваленты клеток GALT.
Первичное воздействие антигена вызывает пролиферацию В-клеток, часть которых превращается в иммунобласты и покидает бляшки. Большая часть клеток остается в бляшках в виде чувствительных к данному антигену В-клеток. При повторном контакте с тем же антигеном эти клетки превращаются в IgA-иммунобласты, которые пролифелируют и мигрируют сначала в брыжеечные лимфатические узлы, а затем через грудной лимфатический проток в кровеносное русло. Часть таких клеток может оседать в отдаленных IgA-секретирующих участках тела. Однако большинство клеток уже в качестве зрелых плазмоцитов осуществляет специфический homing в lamina propria, что обусловлено присутствием антигена и свидетельствует о его определяющей роли в данном процессе.
Вторичный иммунный ответ — сильный и быстрый. Он развивается в течение 48—60 ч, достигает максимума на 4—5-й день, а затем быстро снижается.
Мигрирующие Т-клетки также осуществляют homing в эпителиальном слое слизистой оболочки кишечника. Большинство из этих лимфоцитов обладают Т-хелперным фенотипом. Эти клетки, вероятно, могут вовлекаться в реакции клеточного иммунитета, иммунотолерантности, а также в регуляцию гуморального иммунитета.
Стимулированные местно или осевшие из кровяного русла lgA-продуцирующие клетки в собственной пластинке секретируют IgA в виде димера 9S, проникающего в эпителиальные М-клетки, соединяются с образующимся в них секреторным компонентом и выделяются на поверхность слизистой оболочки в виде иммуноглобулина. Одновременно на поверхность эпителиальных мембран выделяется секреторный компонент в виде свободных молекул. Слизь, обогащенная нековалентно связанными секреторными иммуноглобулинами, выстилает поверхность эпителиальных клеток наподобие ковра. Тем самым обеспечивается протективный эффект, предотвращающий адгезию и инвазию инфекционных агентов.
IgM также продуцируются местно и проявляют свойства, сходные со свойствами секреторного IgA. Показано, что пентамерные 19S молекулы IgM содержат секреторный компонент, хотя эта связь менее прочная.
Продолжительная защита слизистых оболочек местными антителами может быть обусловлена длительной, хотя и умеренной выработкой антител после окончания специфического антигенного воздействия или быстроактивизируемой иммунологической памятью. Обнаружение в системе слизистых оболочек первичного и вторичного иммунного ответа свидетельствует о наличии в ней местной иммунологической памяти, однако ее длительность и уровень вторичного ответа могут зависеть от многих факторов. Например, мыши, иммунизированные интраназально коронавирусом гепатита, имели более продолжительный иммунитет, чем привитые орально. На примере ротавирусной инфекции цыплят доказано, что IgA кишечника являются важным, но не единственным фактором защиты. IgA молозива не адсорбируются в кишечнике новорожденных и остаются там, проявляя местный защитный эффект, нейтрализуя вирус.



